Des stents fabriqués par fusion sélective laser
Par Oksana Banakh, Pierre-Antoine Gay, Tony Journot, Haute École Arc Ingénierie (HES-SO), Groupe ingénierie des surfaces - Suisse
Samuel Rey-Mermet, HES-SO Valais-Wallis - Suisse
Les stents en nitinol, un alliage de mémoire de forme, sont habituellement usinés par découpe laser. Dans cette étude, les auteurs ont utilisé la fusion sélective par laser (SLM) pour imprimer ces stents afin de proposer une alternative viable pour la production de composants métalliques de forme 3D complexe, difficiles à produire par usinage traditionnel. L’électropolissage a amélioré la qualité de surface de ces stents.
Le nitinol, un alliage de nickel et de titane, a trouvé une niche dans l'industrie médicale depuis les années 1990. Les implants cardiovasculaires (stents) représentent plus de 50 % de ce marché et les guide-fils environ 10 %. Parmi les applications récentes, on notera un intérêt grandissant du secteur orthopédique pour le nitinol dans la réalisation d'agrafes, de vis osseuses et d’autres implants. L'alliage y est utilisé pour ses caractéristiques spécifiques que sont la mémoire de forme et la super élasticité, dix fois supérieure à celle des métaux traditionnels. La température de transition entre ces deux propriétés doit être adaptée à la fonction recherchée. Le nitinol possède une bonne résistance à la corrosion, un module de Young proche de celui de l'os et est biocompatible[1].
Une alternative à la découpe laser
Les stents en nitinol sont habituellement usinés par découpe laser. Le but de cette étude était de développer des stents en nitinol en utilisant un procédé innovant, la fusion sélective par laser (Selective Laser Melting, SLM) afin de proposer aux acteurs industriels une alternative viable pour la production de ce type de pièces.
Le développement de cette technologie a permis la fabrication directe de composants métalliques de forme tridimensionnelle complexe (pièces creuses, trous incurvés, structures en filigrane) impossibles à produire par usinage traditionnel. La SLM permet de produire des pièces très denses, pratiquement sans porosités, d’une rugosité élevée, particulièrement sur les peaux inférieures des pièces. Un post-traitement de surface, l’électropolissage, par exemple, est nécessaire pour améliorer la qualité de surface des stents. Ce traitement vise à éliminer les particules de poudre faiblement attachées à la surface des pièces.
Cette étude avait pour objectif de démontrer le potentiel de la technologie SLM pour la fabrication de stents, des pièces de forme complexe. Pour ce faire, les conditions opératoires de la SLM ont été optimisées pour produire des stents super élastiques à mémoire de forme. Le post-traitement a été effectué par électropolissage afin de rendre la surface sans particules de poudre.
Diverses géométries imprimées en 3D
Les stents ont été imprimés en 3D par fusion laser sélective à partir d’une poudre de NiTi comportant 50,8 % de nickel. Ce procédé présente l’avantage de réduire le nombre d’étapes de fabrication par rapport à la voie classique, qui nécessite de nombreux traitements thermiques. Néanmoins, comme toutes les pièces produites par cette méthode, les stents obtenus présentent une grande rugosité de surface correspondant à la taille des particules fondues (~30 mm).
Les stents ont été imprimés en plusieurs lots afin d’optimiser les paramètres d’impression et les géométries. La figure 1 présente les géométries du dernier lot imprimé. Les diamètres minimaux des brins de stents obtenus sont de 200 µm. Le diamètre minimal intérieur est de 6 mm.
Les motifs des mailles choisis pour ce dernier lot de stents ont été calculés par éléments finis afin de s’assurer que la déformation ne dépasse pas 4 % lorsqu’une contraction radiale d’un facteur quatre est imposée au stent.
L’effet mémoire de forme a été testé
Le dernier lot imprimé est présenté sur la figure 2. L’effet mémoire de forme a été testé à l’aide d’un gabarit réduisant le diamètre d’un facteur quatre. Les stents ont retrouvé leur forme originale après avoir été trempés dans une eau de température supérieure à 37 °C. Des essais de fatigue ont été réalisés à l’aide d’un banc d’essais. Les premiers résultats sont prometteurs : les stents, tels qu’imprimés (haute rugosité), survivent à au moins 105 avec une déformation radiale imposée de 1 %. À notre connaissance, peu d’essais de fatigue sont reportés dans la littérature : essais de fatigue en traction sur des pièces en NiTi imprimées par SLM [2] et en compression [3]. Le meilleur résultat obtenu en traction [2] est d’environ 32 000 cycles pour une déformation de maximale de 1 % (R=0,1) sur des éprouvettes de traction polies, ce qui élimine les amorces de fissures causées par la rugosité.
Les températures de transformations mesurées par DSC
En faisant varier la densité d’énergie volumique entre 73 et 250 J/mm3 et la puissance du laser entre 50 et 250 W, il a été possible d’adapter avec précision les températures de transformation AF et MF des stents entre 27 et 98 °C. Ces températures, qui ont été mesurées par calorimétrie différentielle à balayage (DSC), sont indiquées sur la figure 3 en fonction de la puissance et de la densité volumique d’énergie. L’impact entre les paramètres d’impression et les températures de transformation a déjà été étudié dans la littérature, en particulier par Parvizi, Elahinia et al.[1].
Lors de cette étude, il a aussi démontré que les températures de transformation ne varient pas en fonction de la taille de la pièce. Ce qui confirme que cet effet est bien dû à l’évaporation du nickel dans le bain de fusion et non au gradient thermique ou à la vitesse de refroidissement [1]. La figure 5 donne les températures AF pour des cubes de 4x4x6 mm et des stents imprimés à la puissance de 50W, mais avec différentes densités volumiques d’énergie Ev.
Les essais d’électropolissage
Comme mentionné précédemment, les stents bruts imprimés par SLM présentent une rugosité élevée à cause de particules de poudre faiblement attachées à la surface. L'électropolissage est une méthode de traitement de surface qui permet de réduire cette rugosité. Les essais d’électropolissage ont été menés dans un bain d’éthylène glycolé contenant 1,3 %de chlorure de potassium. Un montage comprenant deux contre-électrodes cylindriques – une interne et une externe – imprimées en acier inoxydable et ayant une géométrie proche de celle de stents a été spécifiquement conçue (figure 5).
Après l’électropolissage, une couche de 50 nm de TiO2 a été déposée à la surface des stents par Atomic Layer Deposition(ALD) – un procédé de dépôt de couches minces atomiques–dans le but d’améliorer leur biocompatibilité.
Des tests de cytotoxicité et d’hémocompatibilité
Des tests de cytotoxicité et d’hémocompatibilité ont été réalisés sur trois échantillons : un nonélectropoli, un électropoli et un troisième électropoli revêtus de TiO2. Ils ont révélé que tous les échantillons testés étaient biocompatibles et hémocompatibles. En outre, le revêtement de TiO2 réduit significativement la mortalité des globules rouges, mais elle reste en dessous du seuil toléré pour les deux autres échantillons.
Conclusions et perspectives industrielles
Cette étude avait pour objectif de démontrer le potentiel de la technologie SLM pour la fabrication de pièces de forme complexe. Pour ce faire, les conditions opératoires ont été optimisées pour produire des stents super élastiques au-dessus de 37 °C et à mémoire de forme pour des températures inférieures.
La température de transformation du nitinol est très sensible à sa composition chimique et peut donc être adaptée durant l’impression en modifiant localement l’énergie apportée par le laser. Cela permet d’envisager l’impression de pièces combinant localement les fonctions de mémoire de forme et de super élasticité.
La rugosité de surface a été réduite par électropolissage sur les diamètres extérieur et intérieur du stent en utilisant deux contre-électrodes spécialement conçues. Le dépôt d'une couche de 50 nm de TiO2 réduit considérablement la mortalité des globules rouges, mais les stents non revêtus et même non polis présentent également une hémocompatibilité et une biocompatibilité.
Néanmoins, le diamètre des mailles du stent est limité à 200 µm par la résolution du procédé SLM. Cela restera un inconvénient majeur pour une production industrielle. L'utilisation de l'électropolissage pour réduire ce diamètre est une solution à envisager. La nécessité d'utiliser des contre-électrodes spécifiques au cours de cette étape représente un autre inconvénient qui limite la flexibilité géométrique. Malgré tout, la possibilité d'imprimer des dispositifs en nitinol avec des gradients de composition contrôlés est d'un grand intérêt pour de nombreux domaines spécifiques, tels que l'industrie spatiale ou la microtechnique.
Article publié avec l’aimable autorisation de la revue Oberflächen Polysurfaces.
Bibliographie
[1] S. Parvizi et al., Effective parameters on the final properties of NiTi-based alloys manufactured by powder metallurgy methods : A review, Progress in Materials Science, 117, (2021), 100739.
[2] P. Bayati et al., Toward low and high cycle fatigue behavior of SLM-fabricated NiTi : Considering the effect of build orientation and employing a self-heating approach, International Journal of Mechanical Sciences 185 (2020) 105878.
[3] M. Speirs et al., Fatigue behaviour of NiTi shape memory alloy scaffolds produced by SLM, a unit cell design comparison, Journal of the mechanical behavior of biomedical materials 70 (2017) 53–59.
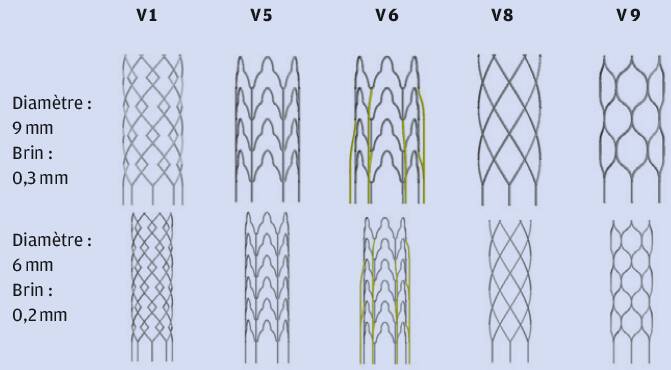
Figure 1 : Diverses géométries des stents imprimés. Les brins jaunes sont des supports servant à évacuer la chaleur. Ils sont détachés à la fin de l’impression.
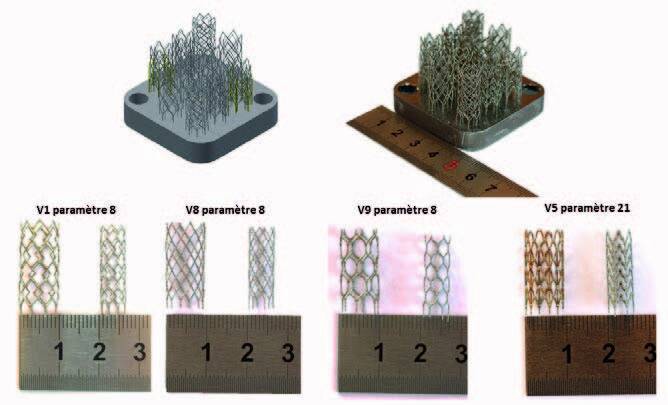
Figure 2 : Dernier lot de stents imprimés.
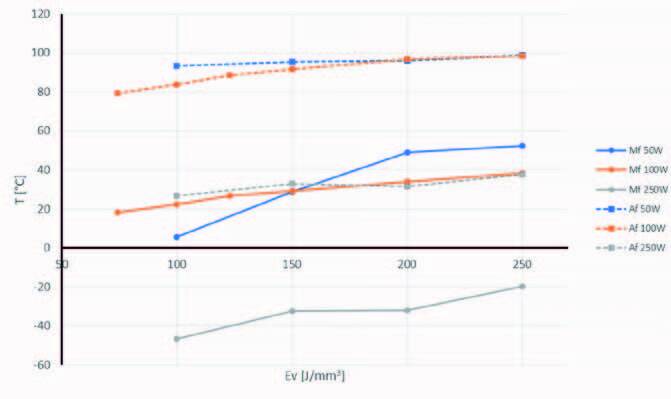
Figure 3 : Températures de transformations mesurées par DSC sur les stents imprimés à la puissance de 50 W et à une densité d’énergie variant entre 100 et 250 J/mm3.
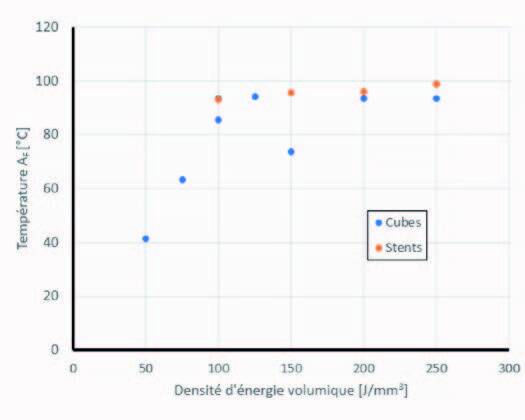
Figure 4 : Comparaison des températures de fin de transformation austénitique AF pour des échantillons cubiques ou des stents imprimés à la puissance de 50 W et à des énergies volumiques variant entre 50 et 250 J/mm3.
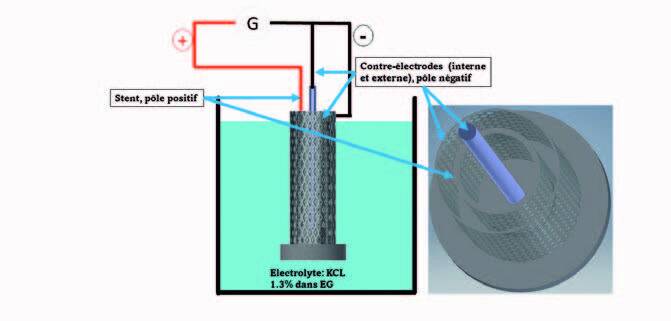
Figure 5 : Vue schématique du montage permettant l’électropolissage des stents. Cette méthode a permis de réduire significativement la rugosité à l’intérieur et à l’extérieur des stents, comme montré sur les figures 6 et 7.

Figure 6 : Réduction de la rugosité par électropolissage sur une plaque de NiTi imprimée par SLM.

Figure 7 : Mcrographies montrant l’effet de l’électropolissage sur l’extérieur (A et B_out) et l’intérieur (A et B_in) des stents.